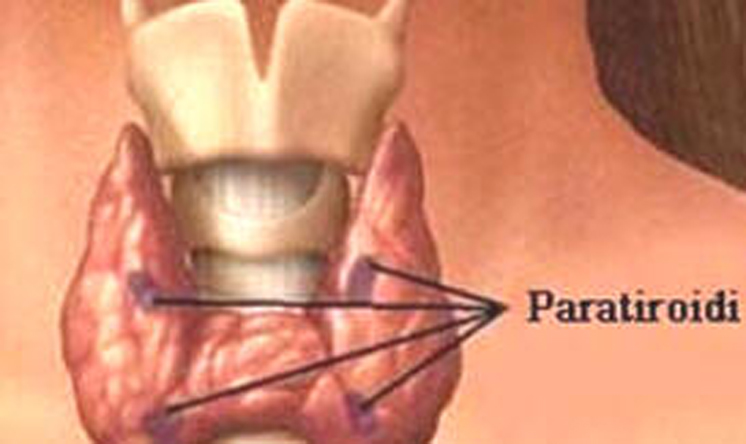
Il comitato per i medicinali per uso umano (CHMP) dell’Agenzia Europea dei Medicinali (EMA) ha adottato un parere positivo raccomandando la concessione condizionale all’immissione in commercio per una proteina umana ricombinante con l’intera sequenza di 84 aminoacidi (rhPTH [1 -84]) dell’ormone paratiroideo endogeno (PTH).
Una volta approvato in via definitiva dall’EMA, il farmaco troverà indicazione come trattamento aggiuntivo per i pazienti adulti affetti da ipoparatiroidismo cronico che non possono essere adeguatamente controllata con la sola terapia standard.
Sviluppato da Shire, una volta approvato in via definitiva sarà posto in commercio con il marchio Natpar.
Il farmaco è un ormone paratiroideo umano ricombinante (PTH), che se approvato sarà disponibile in formulazioni da 25, 50, 75 e 100 microgrammi da somministrarsi una volta al giorno come trattamento aggiuntivo dei pazienti adulti con ipoparatiroidismo cronico che non possono essere adeguatamente controllati con la sola terapia standard.
L’ipoparatiroidismo è stato designato dalla Commissione Europea come malattia orfana.
Dati clinici a supporto del farmaco
La presentazione della domanda di registrazione del farmaco alle autorità regolatorie si è basata sui risultati di uno studio di fase III che ha valutato efficacia e sicurezza di rhPTH (1-84) in uno studio clinico condotto in pazienti di età 18-85 anni, con ipoparatiroidismo cronico. Nello studio, un trial di fase III condotto in doppio-cieco, controllato con placebo, randomizzato, 134 pazienti con ipoparatiroidismo sono stati randomizzati in un rapporto di 2: 1 a placebo o 50 microgrammi una volta al giorno di rhPTH (1-84) per 24 settimane.
L’endpoint primario era una riduzione del 50 per cento o più rispetto al basale nella loro dose giornaliera di calcio per via orale e vitamina D attiva, pur mantenendo una concentrazione di calcio sierico di albumina stabili maggiore o uguale alla concentrazione basale (basale era 2,12 mmol / L per il rhPTH ( 1-84) di gruppo e 2,15 mmol / L per il gruppo placebo) e minore o uguale al limite superiore del valore normale (normale range 2.1-2.6 mmol / L), ma idealmente entro il target range di 2,0-2,25 mmol / L.
Al termine del periodo di follow-up, il 53 per cento dei pazienti trattati con rhPTH (1-84) ha raggiunto l’endpoint primario rispetto al 2 per cento dei pazienti nel gruppo placebo (p <0,0001). [2] L'incidenza complessiva di eventi avversi è risultata simile in entrambi i gruppi. Alla settimana 24, il 93 per cento dei pazienti nel rhPTH (1-84) e il 100 per cento dei pazienti nel gruppo placebo aveva presentato almeno un evento avverso, con ipocalcemia, spasmo muscolare, parestesie, cefalea e nausea essendo i più comuni eventi avversi. Dieci (11 per cento) dei pazienti nel gruppo rhPTH e quattro (9 per cento) nel gruppo placebo hanno avuto eventi avversi gravi; un solo evento avverso grave (ipercalcemia che richiede una degenza ospedaliera breve) nel (1-84) gruppo rhPTH è stato considerato come correlato al trattamento.