Microenvironment-responsive multifunctional enzyme-linked hydrogel for diabetic bone defect regeneration. Fu X, Luo Z, Guo Y, Meng W, Jin S, Chen J, Cai Y, Luo Z, Huang C, Chen A, Guo S, Chen M, Zhou Z, Zeng W. Nat Commun. 2025 Nov 21;16(1):10275. doi: 10.1038/s41467-025-65165-5. PMID: 41271711; PMCID: PMC12639025.
La riparazione dei difetti ossei nel diabete mellito (DM) rappresenta una rilevante sfida clinica, in quanto influenzata da una complessa interazione tra meccanismi sistemici e alterazioni patologiche locali (1-2). I pazienti diabetici presentano tipicamente anomalie del metabolismo scheletrico, tra cui la riduzione della massa ossea e un peggioramento delle qualità dell’osso (2-3). Il microambiente diabetico compromette il differenziamento osteogenico, il turnover osseo e la capacità di guarigione delle fratture (2,4). Inoltre, il 30-40% dei pazienti richiede la somministrazione di insulina esogena per il controllo glicemico, trattamento che paradossalmente sembra favorire un aumento dell’osteoclastogenesi (5). Questo squilibrio tra l’attività degli osteoblasti (OBs) e degli osteoclasti (OCs) può ulteriormente compromettere il processo di riparazione ossea (6-7).
Lo studio di Fu et al., pubblicato nel 2025 sulla rivista Nature Communications, affronta il problema della rigenerazione dei difetti ossei nei pazienti affetti da DM, evidenziando come essa sia compromessa da molteplici fattori, tra cui iperglicemia persistente, infiammazione cronica, stress ossidativo, angiogenesi alterata, squilibrio tra OBs e OCs e disfunzione immunitaria. Le terapie attualmente disponibili agiscono prevalentemente sui singoli aspetti della patologia, risultando pertanto di limitata efficacia. Gli autori propongono quindi una strategia terapeutica “all-in-one” in grado di modulare simultaneamente il microambiente patologico del difetto osseo diabetico.
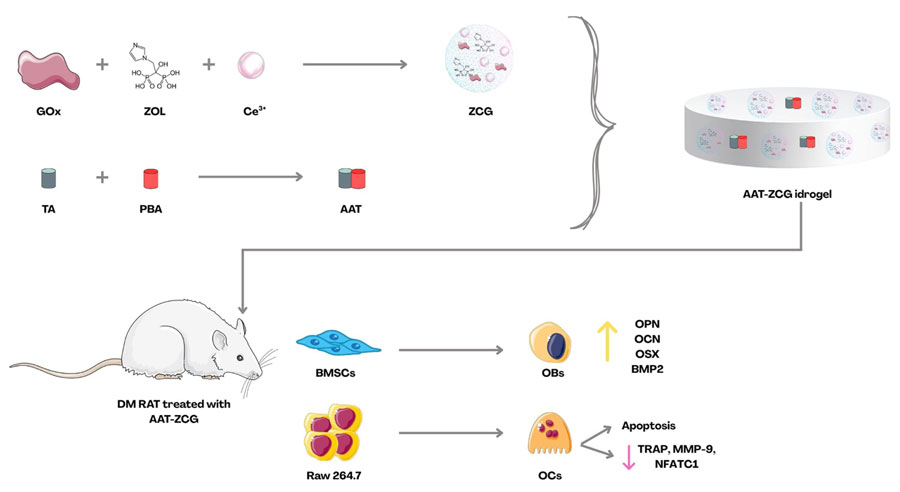
In questo contesto, viene sviluppato un idrogel multifunzionale e microambiente-responsivo, denominato AAT-ZCG, che combina un idrogel dinamico (AAT) e un multi-nanozima (ZCG). L’idrogel AAT è costituito da acido tannico (TA) e acido fenilboronico (PBA) ed è caratterizzato da una rete di legami estere boronici dinamici. Tale struttura conferisce al materiale di rispondere agli elevati livelli di glucosio e di specie reattive dell’ossigeno (ROS), nonché proprietà di auto-riparazione, l’adesione in ambiente umido, particolarmente utile nel contesto osseo, e il rilascio controllato delle componenti terapeutiche. Il sistema ZCG è composto da glucosio ossidasi (GOx), in grado di consumare glucosio, cerio (Ce3+/Ce/4+) con attività simil-SOD e catalasica e funzione di scavenging dei ROS, e acido zoledronico (ZOL), dotato di attività inibitoria sugli OCs. Questo sistema innesca una cascata enzimatica in cui la GOx catalizza l’ossidazione del glucosio a gluconato e H2O2; quest’ultimo, insieme ad altri ROS, viene successivamente neutralizzato dal cerio. L’ambiente acido risultante induce la degradazione del complesso ZCG, con conseguente rilascio di ZOL. Nel microambiente diabetico, il sistema AAT-ZCG riduce l’iperglicemia locale, elimina lo stress ossidativo, modula l’infiammazione promuovendo la polarizzazione dei macrofagi verso il fenotipo M2, stimola l’angiogenesi, favorisce l’osteogenesi e inibisce l’osteoclastogenesi.
Gli esperimenti in vitro, dimostrano che il sistema AAT-ZCG possiede un’elevata biocompatibilità nei confronti di cellule staminali mesenchimali (BMSCs), macrofagi (RAW 264.7) e cellule endoteliali (HUVECs). I dati ottenuti mediante ALP, Alzarin Red, qPCR e immunofluorescenza (IF) indicano che il sistema proposto rappresenta il trattamento più efficace nel promuovere l’osteogenesi e nel determinare una marcata inibizione del differenziamento e attività degli OCs. Il trattamento risulta inoltre efficace nel potenziare l’angiogenesi, aumentando la migrazione cellulare e la formazione di reti vascolari più complesse. AAT-ZCG mostra anche una significativa azione immunomodulatoria, con un aumento dei macrofagi M2 (CD163+) e riduzione dei macrofagi M1 (CD86+). Infine, i dati in vitro evidenziano una notevole capacità di scavenging dei ROS da parte del sistema.
L’analisi molecolare rivela che AAT-ZCG attiva il pathway di FoxO1, il quale risulta fortemente up-regolato favorendo la regolazione positiva dell’osteogenesi, metabolismo osseo e della risposta antiossidante, e inibendo al contempo l’osteoclastogenesi. in particolare, il sistema modula l’asse FoxO1/P53/pP53, riducendo l’espressione di P53 (fattore pro-apoptotico e anti-osteoblastico) e di MMP13, mentre incrementa i livelli di pP53 (forma inattiva) e BMP2. Esperimenti di knock-down confermano che FoxO1 rappresenta un nodo centrale dell’effetto terapeutico osservato.
Gli esperimenti in vivo condotti in un modello di ratto diabetico mostrano che la degradazione dell’idrogel è progressiva e si completa in circa 42 giorni, fornendo un supporto temporale adeguato alla rigenerazione ossea. I dati di micro-CT evidenziano un aumento della BV/TV e una migliore qualità e maturazione del tessuto osseo neoformato. Le analisi istologiche e di IF mostrano una maggiore formazione di osso lamellare, una marcata angiogenesi, un potenziamento dell’osteogenesi, una riduzione dell’infiammazione e un aumento dei macrofagi verso il fenotipo M2. Dal punto di vista della sicurezza, il sistema non evidenzia tossicità sistemica: i principali organi risultano istologicamente normali e i parametri ematici rientrano nei valori fisiologici.
In conclusione, lo studio dimostra che la piattaforma AA-ZCG rappresenta un biomateriale intelligente, multifunzionale e responsivo al microambiente diabetico, capace di affrontare simultaneamente iperglicemia, stress ossidativo, infiammazione, angiogenesi insufficiente e squilibrio tra OBs e OCs. Questa strategia si configura come un approccio promettente per la rigenerazione ossea nei pazienti diabetici, superando i limiti delle terapie a bersaglio singolo.
Referenze:
- Khosla S, Samakkarnthai P, Monroe DG, Farr JN. Update on the pathogenesis and treatment of skeletal fragility in type 2 diabetes mellitus. Nat Rev Endocrinol. 2021 Nov;17(11):685-697. doi: 10.1038/s41574-021-00555-5. Epub 2021 Sep 13. PMID: 34518671; PMCID: PMC8605611.
- Napoli N, Chandran M, Pierroz DD, Abrahamsen B, Schwartz AV, Ferrari SL; IOF Bone and Diabetes Working Group. Mechanisms of diabetes mellitus-induced bone fragility. Nat Rev Endocrinol. 2017 Apr;13(4):208-219. doi: 10.1038/nrendo.2016.153. Epub 2016 Sep 23. PMID: 27658727.
- Aleksova J, Ebeling P, Elder G. The effects of type 1 and type 2 diabetes mellitus on bone health in chronic kidney disease. Nat Rev Endocrinol. 2025 May;21(5):301-313. doi: 10.1038/s41574-024-01083-8. Epub 2025 Jan 16. PMID: 39820573.
- Shanbhogue VV, Hansen S, Frost M, Brixen K, Hermann AP. Bone disease in diabetes: another manifestation of microvascular disease? Lancet Diabetes Endocrinol. 2017 Oct;5(10):827-838. doi: 10.1016/S2213-8587(17)30134-1. Epub 2017 May 22. PMID: 28546096.
- Sheu A, Greenfield JR, White CP, Center JR. Contributors to impaired bone health in type 2 diabetes. Trends Endocrinol Metab. 2023 Jan;34(1):34-48. doi: 10.1016/j.tem.2022.11.003. Epub 2022 Nov 23. PMID: 36435679.
- Zeng J, Guo J, Sun Z, Deng F, Ning C, Xie Y. Osteoblastic and anti-osteoclastic activities of strontium-substituted silicocarnotite ceramics: In vitro and in vivo studies. Bioact Mater. 2020 Apr 6;5(3):435-446. doi: 10.1016/j.bioactmat.2020.03.008. PMID: 32280833; PMCID: PMC7138933.
- Liu S, Lu M, Zhang M, Sun X, Luo B, Wu Y. Multifaceted Catalytic Glucose Depletion and Reactive Oxygen Species-Scavenging Nanoenzyme Composite Hydrogel for Facilitating Diabetic Bone Regeneration. ACS Nano. 2025 Jan 21;19(2):2677-2694. doi: 10.1021/acsnano.4c14596. Epub 2025 Jan 9. PMID: 39783156.