La displasia fibrosa è una patologia rara, che insorge in età infantile, caratterizzata clinicamente da fratture, dolore e deformità e dovuta fisiopatologicamente ad una mutazione con guadagno di funzione del gene GNAS. La mutazione altera la differenziazione delle cellule staminali ossee, provocando la formazione di lesioni espansive, fibrose, altamente proliferative e parzialmente mineralizzate. Tali lesioni sono costituite prevalentemente da osteoclasti (1).
Il denosumab è un farmaco utilizzato prevalentemente nel trattamento dell’osteoporosi. E’ anticorpo monoclonale completamente umano, che lega ed impedisce la normale funzione dell’attivatore del recettore del fattore nucleare κB ligando (receptor activator of nuclear factor κB ligand, RANKL), citochina che stimola l’attività degli osteoclasti, provocandone alla fine l’inibizione. Seppur efficace la sua interruzione è associata ad un potente effetto rebound sul turn-over osseo (2). Il denosumab è stato sperimentato un’unica volta in un paziente affetto da displasia fibrosa, osservandone miglioramenti clinici, ma con un importante effetto rebound (3). Lo studio di De Castro è uno studio di fase 2 (ClinicalTrials.gov numbero di trail: NCT03571191), che nasce per valutare l’efficacia del denosumab nei pazienti affetti da displasia fibrosa e l’entità dell’effetto rebound in questo speciale gruppo di individui.
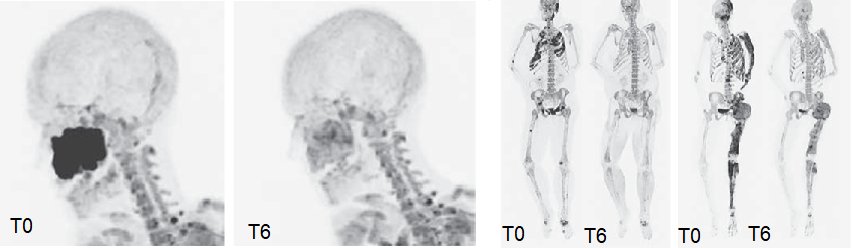
De Castro e colleghi hanno arruolato otto donne affette da displasia fibrose, alle quali è stato somministrato denosumab ad alte dosi per sei mesi e sono state osservate per altri otto mesi ogni quattro settimane dopo l’interruzione del farmaco. Durante i primi sei mesi hanno ricevuto 120 mg di denosumab ogni quattro settimane, con una ulteriore dose di carico alla seconda e terza settimana. Dopo quattro settimane dall’ultima somministrazione di denosumab, le pazienti hanno tutte ricevuto una infusione di acido zoledronico, e successive altre qualora clinicamente indicato. Durante tutto il follow-up, sono stati monitorati laboratoristicamente un marcatore di neo-apposizione ossea, cioè il propeptide N-terminale del procollagene di tipo 1 (procollagen type 1 N-terminal propeptide, P1NP) ed un marcatore di riassorbimento osseo, cioè il telopeptide C-terminale (CTX). E’ stata inoltre eseguita a livello basale e dopo sei mesi di terapia, una tomografia ad emissione di positroni combinata con tomografia computerizzata (PET/TC), usando il fluoruro di sodio marcato con F18 come tracciante osseo, per valutare radiologicamente il grado di attività di malattia. In ultimo è stata eseguita anche una biopsia del tessuto anomalo, sia a livello basale che al termine dei sei mesi di terapia.
Clinicamente, le pazienti hanno riportato miglioramento dei sintomi associati alla displasia fibrosa, come anche miglioramento della vista e della funzione polmonare nei casi di localizzazione rispettivamente cranica e toracica delle lesioni. A livello dei parametri di laboratorio è stata invece osservata una significativa riduzione del P1NP e del CTX durante i primi sei mesi di terapia, e nuovo aumento negli otto mesi successivi. Radiologicamente, è stata osservato ridotto up-take del tracciante alle PET/TC dopo sei mesi di terapia rispetto al livello basale. Le biopsie ossee hanno dimostrato invece: aumentata apposizione ossea; ridotta espressione delle proteine minichromosome maintenance, implicate nella replicazione cellulare; aumentata espressione dell’RNA messaggero di un marker di neo-apposizione ossea, la sclerostina. Al termine dei sei mesi di somministrazione del farmaco, una paziente ha sviluppato ipercalcemia severa (calcio sierico 23 mg/dl) associata ad un aumento del 670% dei livelli di CTX rispetto al basale. La paziente è stata quindi trattata con somministrazione di fluidi, calcitonina, acido zoledronico e denosumab. Successivamente, altre tre pazienti hanno manifestato ipercalcemia moderata con aumento dei marcatori di turn-over osseo.
I risultati di questo studio hanno dimostrato quindi che il denosumab garantisce un miglioramento clinico nei pazienti affetti da displasia fibrosa, riducendo il grado di attività delle lesioni e favorendo la differenziazione degli osteoclasti. Tuttavia hanno dimostrato l’esistenza anche in questo caso di un effetto rebound dei marcatori di turn-over osseo ed un importante effetto collaterale al termine del trattamento, quale l’ipercalcemia, che può comparire in particolare in quei pazienti con grado elevato di malattia.
Questo studio di fase 2, oltre a fornire quindi ulteriori importanti nozioni sulla patogenesi della displasia fibrosa, ha valutato in senso positivo l’efficacia dell’uso del denosumab nel trattamento della malattia. Studi più approfonditi di fase 3 saranno necessari in futuro per analizzare gli importanti effetti collaterali ed il rapporto rischio/beneficio, incontrati già nella fase 2 al momento dell’interruzione del farmaco.
Commento all’articolo di de Castro LF, Michel Z, Pan K, Taylor J, Szymczuk V, Paravastu S, Saboury B, Papadakis GZ, Li X, Milligan K, Boyce B, Paul SM, Collins MT, Boyce AM. Safety and Efficacy of Denosumab for Fibrous Dysplasia of Bone. N Engl J Med. 2023 Feb 23;388(8):766-768. doi: 10.1056/NEJMc2214862. PMID: 36812441.
Bibliografia
- Riminucci M, Liu B, Corsi A, Shenker A, Spiegel AM, Robey PG, Bianco P. The histopathology of fibrous dysplasia of bone in patients with activating mutations of the Gs alpha gene: site-specific patterns and recurrent histological hallmarks. J Pathol. 1999 Jan;187(2):249-58. doi: 10.1002/(SICI)1096-9896(199901)187:2<249::AID-PATH222>3.0.CO;2-J. PMID: 10365102.
- Sølling AS, Harsløf T, Jørgensen NR, Langdahl B. Changes in RANKL and TRAcP 5b after discontinuation of denosumab suggest RANKL mediated formation of osteoclasts results in the increased bone resorption. Osteoporos Int. 2023 Mar;34(3):599-605. doi: 10.1007/s00198-022-06651-0. Epub 2022 Dec 22. PMID: 36543965.
- Boyce AM, Chong WH, Yao J, Gafni RI, Kelly MH, Chamberlain CE, Bassim C, Cherman N, Ellsworth M, Kasa-Vubu JZ, Farley FA, Molinolo AA, Bhattacharyya N, Collins MT. Denosumab treatment for fibrous dysplasia. J Bone Miner Res. 2012 Jul;27(7):1462-70. doi: 10.1002/jbmr.1603. PMID: 22431375; PMCID: PMC3377825.