Nella complessa biologia degli osteoclasti, un ruolo chiave è svolto dai lisosomi secretori (SL), organelli specializzati che conservano le proteine secretorie e che agiscono da lisosomi per la degradazione (1). Al momento, la composizione molecolare e l’organizzazione spazio-temporale dei SL negli osteoclasti è ancora poco conosciuta.
Nel lavoro di Ng e colleghi, pubblicato su Nature Communications lo scorso Febbraio, è analizzata la proteomica degli SL di osteoclasti murini, in cui si evidenzia un arricchimento in proteine coinvolte nel trasporto molecolare; la metà di queste appartengo alla superfamiglia delle proteine “solute carrier” (Slc) e, in seguito ad analisi bioinformatiche e confronti con le banche dati, gli autori hanno identificato la proteina Slc37a2 come la più arricchita. Gli autori procedono quindi a studiare la distribuzione della proteina Slc37a2 negli osteoclasti, individuando una sua co-localizzazione con altre proteine degli endo-lisosomi come ARL38, LAMP2 e Rab7 e la sua completa assenza in altri organelli cellulari, come il reticolo rugoso o l’apparato del Golgi.
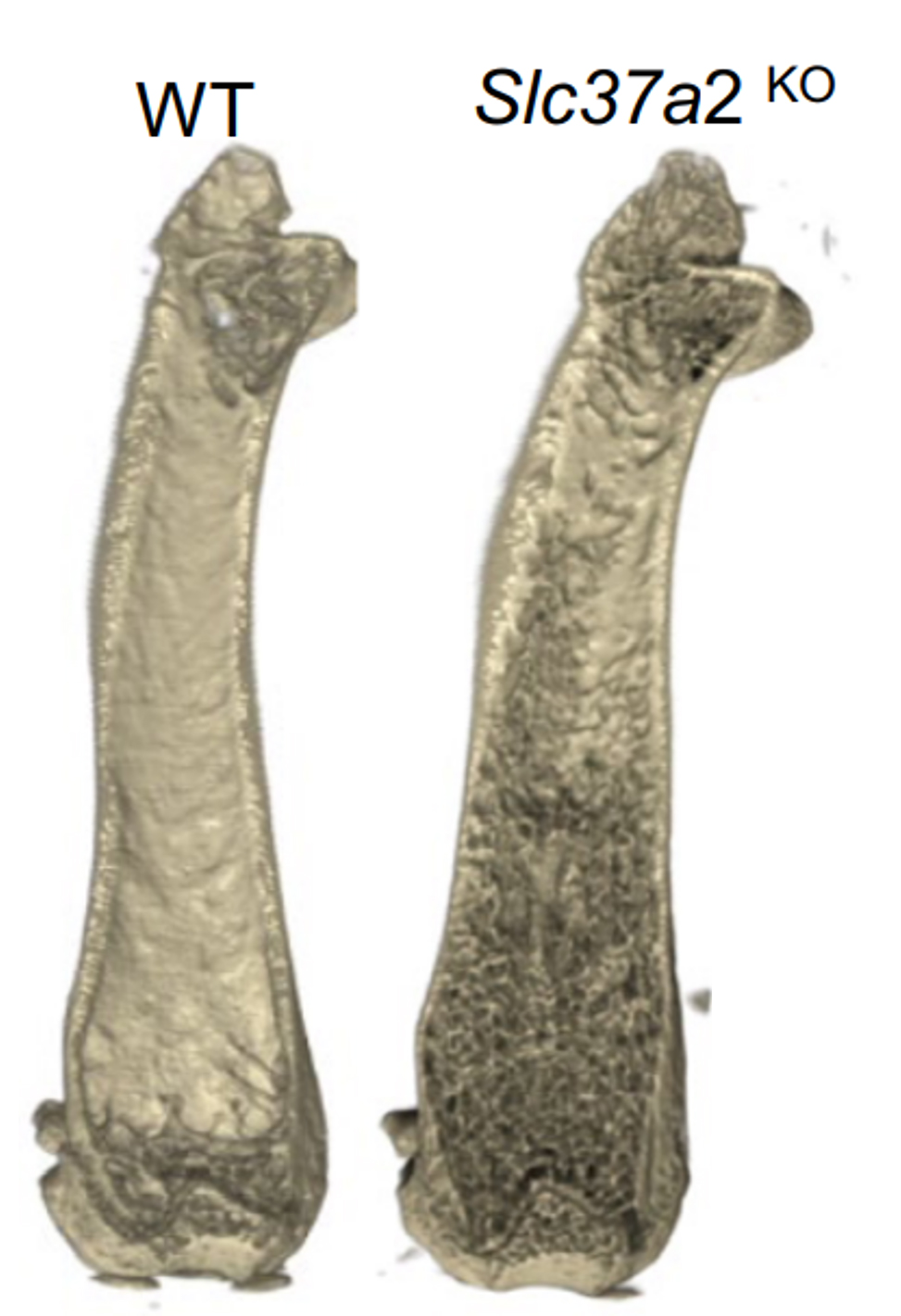
Per comprendere l’importanza fisiologica della proteina Slc37a2 negli osteoclasti e nel metabolismo osseo, gli autori generano un modello murino Slc37a2 knock-out (Slc37a2-/-) che non presenta differenze nella crescita rispetto ai relativi animali wild-type ma all’analisi µCT risulta un aumento della densità ossea, del volume trabecolare e del rapporto BV/TV nell’animale KO. L’analisi istomorfometrica mostra un chiaro fenotipo osteopetrotico del topo Slc37a2-/-, in cui, ad un aumento del numero di osteoclasti non corrisponde un incremento del riassorbimento osseo. Il differenziamento in vitro di osteoclasti a partire da cellule del midollo degli animali Slc37a2-/- conferma che non c’è alterazione nella capacità differenziativa delle cellule degli animali KO rispetto agli animali WT ma solamente nella capacità delle loro cellule di acidificare e digerire la matrice mineralizzata, confermando che la deplezione di Slc37a2 impatta sulla funzione ma non sulla capacità differenziativa degli osteoclasti.
Per comprendere attraverso quale meccanismo Slc37a2 regola la funzione degli osteoclasti, l’analisi metabolomica ha mostrato un ruolo di questa proteina nel metabolismo degli zuccheri; la sua assenza, infatti, implica l’accumulo di glucosio e fruttosio all’interno dei lisosomi, lasciando ipotizzare un suo ruolo nell’esportazione dei monosaccaridi fuori dai SL.
Resta da approfondire il ruolo di Slc37a2 negli osteoblasti e nel crosstalk con gli osteoclasti stessi e quanto l’accumulo di monosaccaridi all’interno degli SL ne impedisca il normale funzionamento (2-4).
Commento a “Sugar Transporter Slc37a2 regulates bone metabolism in mice via tubular lysosomal network in osteoclasts” di Ng PY, Ribet ABP, Guo Q, Mullin BH, Tan JWY, Landao-Bassonga E, Stephens S, Chen K, Yuan J, Abudulai L, Bollen M, Nguyen ETTT, Kular J, Papadimitriou JM, Søe K, Teasdale RD, Xu J, Parton RG, Takayanagi H, Pavlos NJ. Nature Communications (2023) Feb 21;14(1):906. doi: 10.1038/s41467-023-36484-2.
Referenze
1. Blott EJ, Griffiths GM. Secretory lysosomes. Nat Rev Mol Cell Biol. 2002;3(2):122-31.
2. Bandyopadhyay D, Cyphersmith A, Zapata JA, Kim YJ, Payne CK. Lysosome transport as a function of lysosome diameter. PLoS One. 2014;9(1):e86847.
3. Bright NA, Davis LJ, Luzio JP. Endolysosomes Are the Principal Intracellular Sites of Acid Hydrolase Activity. Curr Biol. 2016;26(17):2233-45.
4. Swanson J, Yirinec B, Burke E, Bushnell A, Silverstein SC. Effect of alterations in the size of the vacuolar compartment on pinocytosis in J774.2 macrophages. J Cell Physiol. 1986;128(2):195-201.