Commento all’articolo: Remodeling adipocytes’ lipid metabolism with a polycation loaded enzyme-active framework reverses osteoporotic bone marrow. Lin W, Gu S, Zhang X, Li K, Zhao D, Ma B, Pan C, Xu Z, Liu T, Wang H, Hu S, Chen H. Nat Commun. 2025 Aug 27;16(1):8009. doi: 10.1038/s41467-025-63376-4. PMID: 40866384; PMCID: PMC12391307.
L’accumulo di adipociti all’interno della cavità midollare conduce alla formazione del tessuto adiposo midollare (Bone Marrow Adipose Tissue, BMAT), il quale svolge un ruolo chiave in numerosi processi fisiopatologici (1,2). La proliferazione degli adipociti midollari (Bone Marrow Adipocytes, BMAds) può influenzare la funzione delle altre popolazioni cellulari del midollo osseo attraverso la secrezione di diverse molecole bioattive, tra cui lipidi, citochine, chemochine e adipochine (3-6). Inoltre, le BMAds secernono fattori associati al fenotipo secretorio della senescenza (senescence-associated secretory phenotype, SASP) contribuendo alla modulazione della senescenza cellulare. È stato ipotizzato che gli acidi grassi rilasciati da queste cellule possano indurre senescenza nelle cellule adiacenti, incluse le cellule stromali midollari (BMSCs) e gli osteoblasti (OBs). Ciò potrebbe essere attribuito al fatto che i lipidi accumulati nel midollo osseo agiscano come molecole bioattive in grado di interferire con la funzione fisiologica degli OBs (7,8).
Lo studio di Lin et al., pubblicato nel 2025 sulla rivista Nature Communications, si pone come obiettivo principale l’analisi del contributo del metabolismo lipidico alterato delle BMAds allo sviluppo dell’osteoporosi, nonché la dimostrazione del ruolo dei lipidi nel danno mitocondriale e nell’induzione della senescenza cellulare. Un ulteriore obiettivo dello studio è lo sviluppo di una strategia terapeutica mirata alla riprogrammazione del metabolismo lipidico delle BMAds, con lo scopo di ripristinare l’omeostasi del microambiente midollare.
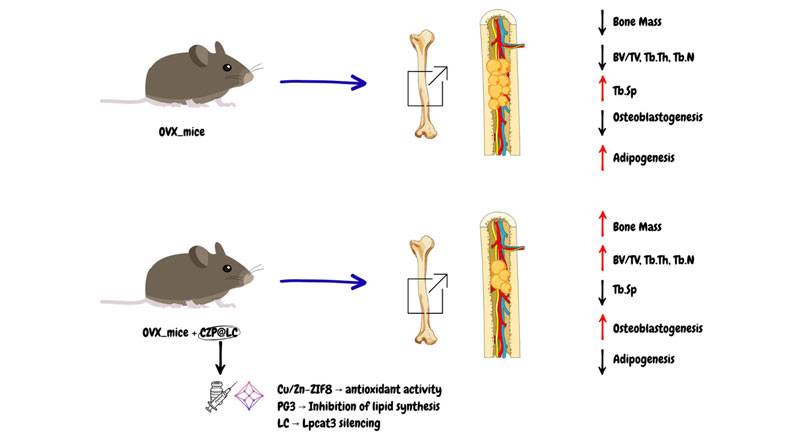
Gli autori hanno utilizzato un modello murino di osteoporosi indotta da ovariectomia (OVX). In tale modello è stata osservata una riduzione significativa della massa ossea, accompagnata da un progressivo aumento degli adipociti midollari. Inoltre, il microambiente midollare dei topi OVX mostrava un incremento dei lipidi liberi. L’analisi lipidomica ha evidenziato un aumento degli acidi grassi (fatty acids, FA), in particolare dell’acido arachidonico (AA), nonché un marcato incremento delle acilcarnitine, indicativo di un’eccessiva ossidazione mitocondriale degli acidi grassi (fatty acid oxidation, FAO). Questo profilo lipidico risulta essere strettamente associato a disfunzione mitocondriale e all’insorgenza della senescenza cellulare.
Lo studio sottolinea inoltre come le BMAds siano in grado di indurre senescenza e di compromettere l’osteogenesi. In particolare, l’AA e gli altri acidi grassi favoriscono il differenziamento adipogenico delle BMSCs e inibiscono il differenziamento degli OBs. In questi ultimi si osservano una riduzione del potenziale di membrana mitocondriale, un aumento dei livelli di specie reattive dell’ossigeno (ROS), l’attivazione delle vie mitofagiche e l’induzione della senescenza cellulare. Tali effetti risultano mediati, almeno in parte, dall’attivazione della via di segnalazione di PPARg. Gli autori dimostrano come nel microambiente midollare si instauri un circolo vizioso caratterizzato da un aumento degli adipociti e della secrezione lipidica, che a sua volta induce danno mitocondriale, riduzione dell’osteogenesi e ulteriore incremento dell’adipogenesi.
Nello lavoro viene inoltre proposto un approccio terapeutico innovativo basato sulla nanoplatform CZP@LC, una nanostruttura multifunzionale composta da: Cu/Zn-ZIF8, una struttura metallo-organica porosa dotata di attività antiossidannte di tipo SOD/CAT e capace di ridurre i livelli di ROS; poliamidoammina cationica (PG3) che consente un targeting selettivo delle BMAds e l’inibizione diretta della sintesi lipidica; e un plasmide CRISPR/Cas9 (LC) mirato al silenziamento di Lpcat3, enzima chiave nella perossidazione lipidica e nella produzione di fosfolipidi arachidonici.
Il sistema risulta stabile a pH fisiologico, viene rilasciato selettivamente in ambiente midollare acido ed è caratterizzato da biocompatibilità e biodegradabilità. Il trattamento delle BMAds con CZP@LC determina una marcata riduzione della sintesi lipidica, con diminuzione delle gocce lipidiche, della perossidazione lipidica (LPO) e dell’espressione dei geni adipogenici, portando a un blocco del differenziamento adipogenico.
Negli OBs, il trattamento ripristina la funzionalità mitocondriale, determinando un aumento del potenziale di membrana, una riduzione dei ROS e un miglioramento della capacità respiratoria. Parallelamente, si osserva una riduzione della senescenza cellulare, un incremento dell’espressione dei marker osteogenici e un aumento della mineralizzazione ossea..
Nel modello in vivo, il trattamento con CZP@LC determina un incremento dei parametri ossei BV/TV, Tb.Th e Tb.N, accompagnato da una riduzione della Tb.Sp. Nei topi OVX trattati si osserva inoltre una riduzione significativa delle BMAds nel midollo osseo. L’effetto terapeutico risulta superiore a quello dell’alendronato e si dimostra efficace sia nella stabilizzazione dell’osteoporosi conclamata sia nel contrastare l’osteoporosi associata a una dieta ad alto contenuto di grassi. Dal punto di vista della sicurezza, il trattamento evidenzia tossicità sistemica, né danni a carico di fegato, reni o a altri organi, e non mostra effetti off-target legati all’utilizzo del sistema CRISPR.
In conclusione, questo lavoro dimostra che le BMAds non sono semplici cellule di supporto, ma svolgono un ruolo attivo nella progressione dell’osteoporosi attraverso la secrezione aberrante di lipidi. Tali lipidi alterano il metabolismo mitocondriale delle cellule del microambiente midollare, favorendo la senescenza cellulare e compromettendo l’osteogenesi. In questo contesto, la riprogrammazione del metabolismo lipidico delle BMAds emerge come una strategia terapeutica efficace. La nanoplatform CZP@LC rappresenta un approccio innovativo, mirato e funzionale, con un elevato potenziale di traslazione clinica.
Referenze:
- Wang Y, Yang C, Wan J, Liu P, Yu H, Yang X, Ma D. Bone marrow adipocyte: Origin, biology and relationship with hematological malignancy. Int J Lab Hematol. 2024 Feb;46(1):10-19. doi: 10.1111/ijlh.14198. Epub 2023 Nov 5. PMID: 37926488.
- Hardouin P, Rharass T, Lucas S. Bone Marrow Adipose Tissue: To Be or Not To Be a Typical Adipose Tissue? Front Endocrinol (Lausanne). 2016 Jun 30;7:85. doi: 10.3389/fendo.2016.00085. PMID: 27445987; PMCID: PMC4928601.
- Cawthorn WP, Scheller EL, Learman BS, Parlee SD, Simon BR, Mori H, Ning X, Bree AJ, Schell B, Broome DT, Soliman SS, DelProposto JL, Lumeng CN, Mitra A, Pandit SV, Gallagher KA, Miller JD, Krishnan V, Hui SK, Bredella MA, Fazeli PK, Klibanski A, Horowitz MC, Rosen CJ, MacDougald OA. Bone marrow adipose tissue is an endocrine organ that contributes to increased circulating adiponectin during caloric restriction. Cell Metab. 2014 Aug 5;20(2):368-375. doi: 10.1016/j.cmet.2014.06.003. Epub 2014 Jul 3. PMID: 24998914; PMCID: PMC4126847.
- Scheller EL, Burr AA, MacDougald OA, Cawthorn WP. Inside out: Bone marrow adipose tissue as a source of circulating adiponectin. Adipocyte. 2016 Mar 22;5(3):251-69. doi: 10.1080/21623945.2016.1149269. PMID: 27617171; PMCID: PMC5014002.
- Sulston RJ, Cawthorn WP. Bone marrow adipose tissue as an endocrine organ: close to the bone? Horm Mol Biol Clin Investig. 2016 Oct 1;28(1):21-38. doi: 10.1515/hmbci-2016-0012. PMID: 27149203.
- Horowitz MC, Berry R, Holtrup B, Sebo Z, Nelson T, Fretz JA, Lindskog D, Kaplan JL, Ables G, Rodeheffer MS, Rosen CJ. Bone marrow adipocytes. Adipocyte. 2017 Jul 3;6(3):193-204. doi: 10.1080/21623945.2017.1367881. Epub 2017 Aug 24. PMID: 28872979; PMCID: PMC5638373.
- Xia W, Veeragandham P, Cao Y, Xu Y, Rhyne TE, Qian J, Hung CW, Zhao P, Jones Y, Gao H, Liddle C, Yu RT, Downes M, Evans RM, Rydén M, Wabitsch M, Wang Z, Hakozaki H, Schöneberg J, Reilly SM, Huang J, Saltiel AR. Obesity causes mitochondrial fragmentation and dysfunction in white adipocytes due to RalA activation. Nat Metab. 2024 Feb;6(2):273-289. doi: 10.1038/s42255-024-00978-0. Epub 2024 Jan 29. PMID: 38286821; PMCID: PMC10896723.
- Yamauchi S, Sugiura Y, Yamaguchi J, Zhou X, Takenaka S, Odawara T, Fukaya S, Fujisawa T, Naguro I, Uchiyama Y, Takahashi A, Ichijo H. Mitochondrial fatty acid oxidation drives senescence. Sci Adv. 2024 Oct 25;10(43):eado5887. doi: 10.1126/sciadv.ado5887. Epub 2024 Oct 25. PMID: 39454000; PMCID: PMC11506141.