Commento all’articolo: SPI1 activates mitochondrial unfolded response signaling to inhibit chondrocyte senescence and relieves osteoarthritis. Zu X, Chen S, Li Z, Hao L, Fu W, Zhang H, Yin Z, Wang Y, Wang J. Bone Res. 2025 Apr 14;13(1):47. doi: 10.1038/s41413-025-00421-4. PMID: 40229258; PMCID: PMC11997156.
L’osteoartrite (OA) è una patologia cronico-degenerativa, caratterizzata dalla progressiva compromissione della cartilagine articolare (AC) (1). In condizioni fisiologiche, l’AC presenta un’intensa attività metabolica e sintetica, in particolare nella produzione delle componenti della matrice cartilaginea (2). Durante i processi degenerativi, i condrociti sviluppano un fenotipo senescente, arrestano la proliferazione e rilasciano molecole pro-infiammatorie riconducibili al Senescence-associated secretory phenotype (SASP) (3).
Analisi bioinformatiche hanno inoltre suggerito un possibile coinvolgimento del fattore di trascrizione SPI1, noto anche come PU.1, e appartenente alla famiglia delle E-twenty-six family (ETS), nella patogenesi dellOA (4).
Uno studio di Zu et al., pubblicato nel 2025 sulla rivista Bone Research, ha evidenziato il ruolo chiave di SPI1 nella regolazione della senescenza condrocitaria e nella modulazione della progressione dell’OA.
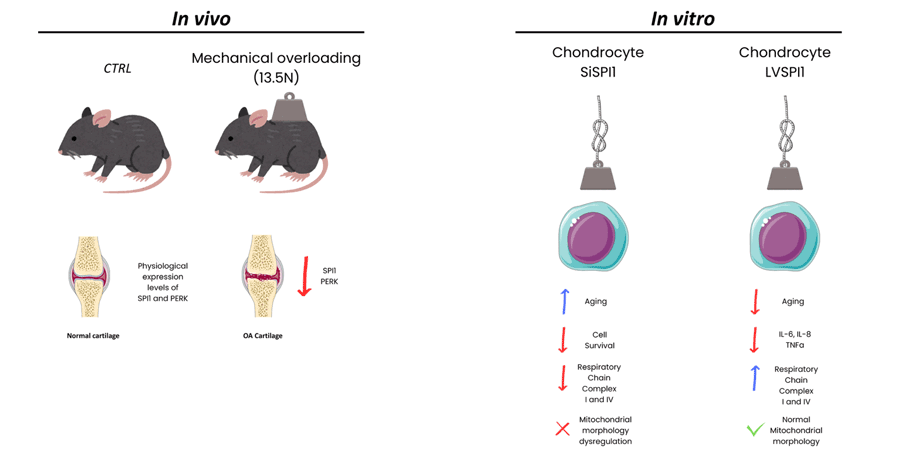
Nella fase iniziale del lavoro, analisi di immunoistochimiche (IHC), proteomiche e di espressione genica, hanno mostrato una riduzione dei livelli di SPI1 e PERK nei campioni di cartilagine di pazienti con OA. Risultati analoghi sono stati osservati in un modello murino di sovraccarico meccanico, caratterizzato da una marcata degenerazione cartilaginea accompagnata da una diminuzione dell’espressione di SPI1 e PERK.
È noto che uno stress meccanico anomalo può accelerare la degenerazione del tessuto cartilagineo attivando specifiche vie di segnalazione nei condrociti (5). Per indagare l’eventuale relazione tra SPI1 e PERK, gli autori hanno condotto studi in vitro su condrociti articolari umani (hAC) isolati da pazienti con OA. In condizioni di stress meccanico, tali cellule mostravano una riduzione dei livelli di SPI1 e PERK, insieme ad un aumento dell’espressione di citochine infiammatorie come IL-6, IL-8 e TNFa. Inaspettatamente, gli esperimenti hanno anche evidenziato l’attivazione della risposta mitoncondriale UPRmt (mitochondrial unfolded protein response). Per avvalorare questi dati gli autori hanno utilizzato il modello murino di topo ko condizionato per SPI1 (SPI1f/fCol2a1-CreERT2). In assenza di sovraccarico meccanico, i topi non sviluppavano il fenotipo OA, mentre in condizioni di stress meccanico, mostravano una severa degenerazione articolare. Analisi IHC hanno inoltre rivelato una concomitante riduzione di SPI1, PERK e Col2a1, ed un aumento dei marker di senescenza (p16 e p21).
Per valutare il ruolo di SPI1 nell’inibizione della senescenza indotta da stress meccanico, gli autori hanno eseguito esperimenti di silenziamento (SiSPI1) e di over-espressione (LVSPI1) di SPI1. Nei condrociti SiSPI1 sottoposti a stress meccanico si osservavano livelli più elevati di citochine infiammatore e di marker di senescenza, insieme a una riduzione dell’attività dei complessi I e IV della catena respiratoria e a un’alterazione della morfologia mitocondriale. Al contrario, i condrociti LVSPI1 mostravano una riduzione dell’espressione delle citochine infiammatorie e dei marker di senescenza, un aumento dell’attività dei complessi respiratori I e IV, e una morfologia mitocondriale preservata.
Ulteriori esperimenti in vitro, hanno confermato che SPI1 si lega al promotore di PERK, promuovendone la sua trascrizione, e che l’attivazione di PERK è fondamentale per l’attivazione della URPmt el’inibizione della senescenza condrocitaria.
In conclusione, lo studio dimostra che SPI1, legandosi al promotore di PERK, ne stimola l’attività trascrizionale e attiva la risposta mitocondriale URPmt, contribuendo a contrastare la senescenza dei condrociti nei contesti di OA.
Referenze:
- Quicke JG, Conaghan PG, Corp N, Peat G. Osteoarthritis year in review 2021: epidemiology & therapy. Osteoarthritis Cartilage. 2022 Feb;30(2):196-206. doi: 10.1016/j.joca.2021.10.003. Epub 2021 Oct 22. PMID: 34695571.
- Zhen G, Guo Q, Li Y, Wu C, Zhu S, Wang R, Guo XE, Kim BC, Huang J, Hu Y, Dan Y, Wan M, Ha T, An S, Cao X. Mechanical stress determines the configuration of TGFβ activation in articular cartilage. Nat Commun. 2021 Mar 17;12(1):1706. doi: 10.1038/s41467-021-21948-0. PMID: 33731712; PMCID: PMC7969741.
- Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621. doi: 10.1016/0014-4827(61)90192-6. PMID: 13905658.
- Dong S, Xia T, Wang L, Zhao Q, Tian J. Investigation of candidate genes for osteoarthritis based on gene expression profiles. Acta Orthop Traumatol Turc. 2016 Dec;50(6):686-690. doi: 10.1016/j.aott.2016.04.002. Epub 2016 Nov 18. PMID: 27866912; PMCID: PMC6197383.
- Zhang H, Shao Y, Yao Z, Liu L, Zhang H, Yin J, Xie H, Li K, Lai P, Zeng H, Xiao G, Zeng C, Cai D, Bai X. Mechanical overloading promotes chondrocyte senescence and osteoarthritis development through downregulating FBXW7. Ann Rheum Dis. 2022 May;81(5):676-686. doi: 10.1136/annrheumdis-2021-221513. Epub 2022 Jan 20. PMID: 35058228.