Commento all’articolo: Mouse model of anti-RANKL discontinuation reveals reduced bone mass and quality through disruption of bone remodeling. Ishikawa K, Tani S, Sakai N, Kudo Y, Horiuchi H, Kimura-Suda H, Takami M, Tsuji M, Inagaki K, Kiuchi Y, Negishi-Koga T. Bone Res. 2025 May 28;13(1):56. doi: 10.1038/s41413-025-00433-0. PMID: 40425548; PMCID: PMC12116787.
Molti agenti terapeutici efficaci contro l’osteoporosi, come il denosumab e i bifosfonati, sono stati sviluppati privilegiando i loro effetti anti-catabolici, mentre il teriparatide e il romosozumab si basano principalmente su attività pro-anaboliche (1). Il denosumab è un anticorpo monoclonale che agisce contro Receptor Activator of Nuclear Factor Kappa B ligand (RANKL), impedendone l’interazione con il recettore RANK presente sui precursori degli osteoclasti (Ocs) ed inibendo così l’osteoclastogenesi (2). Ad oggi è ampiamente utilizzato per il trattamento dell’osteoporosi e dell’artrite reumatoide, oltre che nella prevenzione delle complicanze scheletriche associate a tumori solidi. Nonostante il trattamento risulti essere efficace contro l’osteoporosi, la sua sospensione è associata ad un rapido incremento del turnover osseo (overshoot) e ad un aumentato rischio di fratture vertebrali multiple (3-5). Ad oggi la fisiopatologia di questo fenomeno, tuttavia, non è ancora del tutto chiarita.
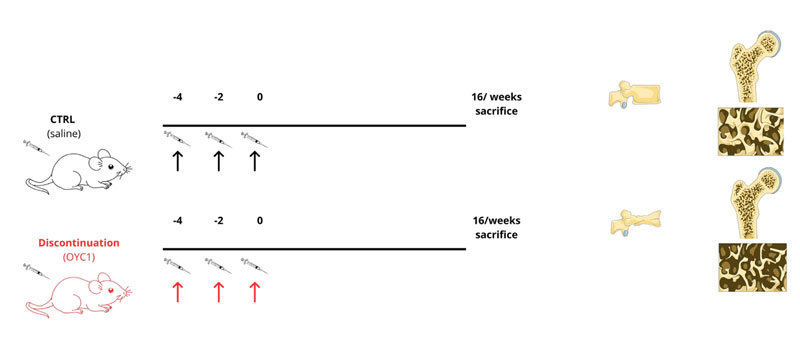
Uno studio di Ishikawa et al., pubblicato nel 2025 su Bone Research, ha approfondito gli effetti provocati dall’interruzione del trattamento con anti-RANKL (Denosumab). Gli autori hanno innanzitutto valutato il fenomeno dell’overshoot nei pazienti, osservando, dopo la sospensione del denosumab, un aumento dei livelli del marcatore di riassorbimento TRAP-5b oltre i valori pre-trattamento, un ritorno della densità minerale ossea (BMD) ai livelli basali e una perdita di massa ossea superiore a quella fisiologia attesa per l’età. In una seconda fase, il fenomeno è stato analizzato in un modello murino sottoposto a trattamento discontinuo con anti-RANKL (3 iniezioni). Nei topi, dopo 6 settimane dalla sospensione, si osservavano un marcato overshoot del riassorbimento, elevati livelli di TRAP, catepsina k e fosfatasi acida tartarato resistente (Acp5). Fino a 16 settimane dopo l’interruzione si registravano una perdita di massa ossea rapida e persistente e una significativa riduzione di BMD trabecolare e corticale, di bone volume (BV) e spessore trabecolare (Tb.Th). In aggiunta, la spettroscopia FTIR evidenziava una riduzione del rapporto matrice mineralizzata/matrice non mineralizzata, una ridotta cristallinità ed alterazione della composizione della matrice ossea. Test meccanici confermavano una ridotta capacità di carico, una minore elasticità ed una maggiore deformazione al momento della frattura. Nel complesso, tali risultati mostrano che, analogamente ai pazienti, anche nel modello murino l’interruzione della terapia determina una marcata fragilità ossea dovuta alla perdita sia di massa che di qualità del tessuto.
Nel modello murino, l’overshoot induce simultaneamente un drastico aumento degli Ocs e una riduzione del numero e dell’attività degli osteoblasti (Obs). Sorprendentemente, anche dopo la normalizzazione del riassorbimento, la formazione ossea rimane a lungo soppressa, suggerendo un rimodellamento non accoppiato in cui il riassorbimento si ripristina, mentre la formazione resta inibita.
Per chiarire se la perdita di massa ossea sia una conseguenza specifica della modalità d’azione del farmaco, gli autori hanno confrontato l’anti-RANL con i bifosfonati. La sospensione dei bifosfonati non causava né overshoot nè gravi perdite di massa ossea, sottolineando come l’effetto osservato con l’anti-RANKL sia specifico e legato alla sua diversa farmacocinetica. Inoltre, nel modello murino il trattamento con anti-RANKL favoriva l’accumulo latente di precursori osteoclastici, pronti a differenziare non appena cessava l’inibizione.
La scoperta più rilevante riguarda il ruolo delle vescicole extracellulari (EVs) circolanti, che sembrano fungere da trasportatori di RANKL. Durante la terapia con denosumab, le EVs aumentano e l’anticorpo ne impedisce la clearance mediata da macrofagi, i quali di fatto mascherano il RANKL. Con la sospensione del trattamento, le EVs vengono “liberate”, fornendo un forte stimolo all’osteoclastogenesi e contribuendo al burst osteoclastico.
Gli autori hanno inoltre dimostrato che, alla sospensione del trattamento con anti-RANKL, si verifica una marcata riduzione di progenitori degli osteoblasti. Di conseguenza, oltre all’aumento dei processi di riassorbimento, viene compromessa anche la capacità di neoformazione, che rimane ridotta per lungo tempo, anche dopo la fine dell’overshoot.
In conclusione, lo studio dimostra che l’interruzione della terapia anti-RANKL provoca un accumulo di precursori osteoclastici e di EVs contenenti RANKL durante il trattamento, causando un forte squilibrio del processo di rimodellamento osseo: il riassorbimento aumenta nettamente, mentre la formazione resta inibita a causa della riduzione dei progenitori degli Obs. Ne deriva una perdita di massa ossea più severa e persistente, accompagnata da un deterioramento della qualità ossea e da un aumento significativo della fragilità scheletrica.
Referenze:
- Khosla S, Hofbauer LC. Osteoporosis treatment: recent developments and ongoing challenges. Lancet Diabetes Endocrinol. 2017 Nov;5(11):898-907. doi: 10.1016/S2213-8587(17)30188-2. Epub 2017 Jul 7. PMID: 28689769; PMCID: PMC5798872.
- Bekker PJ, Holloway DL, Rasmussen AS, Murphy R, Martin SW, Leese PT, Holmes GB, Dunstan CR, DePaoli AM. A single-dose placebo-controlled study of AMG 162, a fully human monoclonal antibody to RANKL, in postmenopausal women. J Bone Miner Res. 2004 Jul;19(7):1059-66. doi: 10.1359/JBMR.040305. Epub 2004 Mar 1. PMID: 15176987.
- Anastasilakis AD, Polyzos SA, Makras P, Aubry-Rozier B, Kaouri S, Lamy O. Clinical Features of 24 Patients With Rebound-Associated Vertebral Fractures After Denosumab Discontinuation: Systematic Review and Additional Cases. J Bone Miner Res. 2017 Jun;32(6):1291-1296. doi: 10.1002/jbmr.3110. Epub 2017 Mar 13. PMID: 28240371.
- Fassio A, Adami G, Benini C, Vantaggiato E, Saag KG, Giollo A, Lippolis I, Viapiana O, Idolazzi L, Orsolini G, Rossini M, Gatti D. Changes in Dkk-1, sclerostin, and RANKL serum levels following discontinuation of long-term denosumab treatment in postmenopausal women. Bone. 2019 Jun;123:191-195. doi: 10.1016/j.bone.2019.03.019. Epub 2019 Mar 22. PMID: 30910600.
- Brown JP, Dempster DW, Ding B, Dent-Acosta R, San Martin J, Grauer A, Wagman RB, Zanchetta J. Bone remodeling in postmenopausal women who discontinued denosumab treatment: off-treatment biopsy study. J Bone Miner Res. 2011 Nov;26(11):2737-44. doi: 10.1002/jbmr.448. PMID: 21735475.