Commento all’articolo: Mechanical characterization of Col1a1+/− osteogenesis imperfecta bone revealed altered mechanical stiffness heterogeneity across scales. Fan H, Busschers E, Tanoto H, Prabhu A, Bui DS, Nguyen P, Kehl J, Berrospe-Rodriguez C, Chen Y, Leynes C, Aguilar G, Bae Y, Lee B, 2,5 and Zhou Y. Cell Biomaterials (2025), https://doi.org/10.1016/j.celbio.2025.100246
L’osteogenesi Imperfetta (OI) è una patologia di origine genetica caratterizzata da fragilità ossea, causata principalmente da mutazioni nei geni COL1A1 e COL1A2, che codificano per il collagene di tipo I (ColI) (1). L’OI è associata a un’aumentata incidenza di fratture e a numerosi altri disordini che coinvolgono diversi tessuti, tra cui pelle, tendini e sclera (2,3). La gravità della patologia dipende dalla specifica variante genetica e lo spettro fenotipico viene comunemente classificato in forme lievi (tipo I), moderate/severe (tipo IV, III) e molto severe (tipo II) (4). Tale classificazione si basa sulla gravità delle deformazioni scheletriche, sulla frequenza delle fratture e sulla presenza di altre manifestazioni sistematiche.
Lo scopo principale dello studio di Fan et al., pubblicato nel 2025 sulla rivista Cell Biomaterials, è quello di correlare in modo diretto e quantitativo le alterazioni nanoscalari e microscalari dell’osso, quali composizione del collagene, grado di mineralizzazione e organizzazione lamellare, con le proprietà meccaniche a livello tissutale e dell’osso intero, mediante un approccio integrato e multiscala.
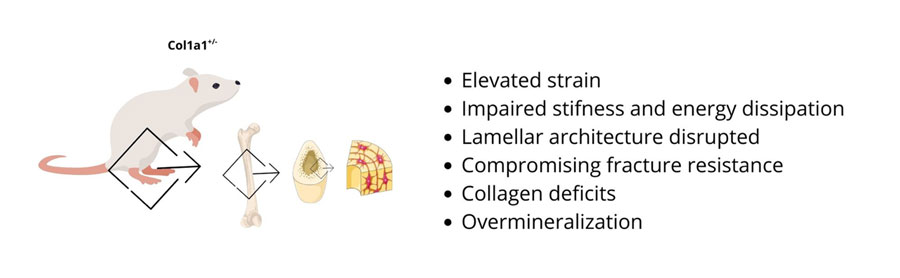
Nello studio sono stati utilizzati topi maschi Col1a1+/- (modello di OI di tipo I) di 12 settimane di età. Il femore è stato analizzato mediante micro-CT, la Digital Volume Correlation (DVC), la microscopia a forza atomica (AFM) e la spettroscopia di Raman. I risultati mostrano che, sotto compressione assiale, i femori OI presentano una maggiore deformazione globale rispetto ai controlli. Inoltre, l’analisi DVC 3D evidenzia regioni caratterizzate da elevati livelli di strain, localizzate prevalentemente a livello della diafisi. L’analisi micro-CT rivela una Bone Mineral Density (BMD) mediamente più elevata nei femori OI, ma distribuita in modo più eterogeneo, con la presenza di regioni iper-mineralizzate. Questi dati indicano che, nei topi OI, l’aumento della mineralizzazione non si traduce in un miglioramento della competenza meccanica, ma contribuisce piuttosto a una risposta fragile e disomogenea del tessuto osseo.
A livello tissutale, le misurazioni di AFM, in particolare della rigidità elastica e della dissipazione energetica, mostrano un’eterogeneità spaziale significativamente maggiore nei topi OI rispetto ai controlli. Nei topi transgenici è inoltre evidente una marcata variabilità tra diverse regioni anatomiche dello stesso osso. Nell’OI, le aree caratterizzate da maggiore rigidità risultano associate a una ridotta capacità di dissipare energia, favorendo condizioni di accumulo di stress osseo. Questo assetto “a mosaico”, a livello tissutale ostacola una distribuzione uniforme del carico e predispone alla formazione e propagazione di microfratture.
Per quanto riguarda l’organizzazione delle strutture lamellari, nei femori OI si osserva una perdita o attenuazione dell’alternanza tra lamelle più morbide e più rigide, una diversa distribuzione del modulo elastico e una ridotta definizione delle lamelle stesse. Ciò indica che, nei topi OI, la capacità di contrastare l’insorgenza delle fratture risulta compromessa anche a livello lamellare.
Lo studio evidenzia inoltre una riduzione significativa del contenuto di Col I e una sua distribuzione più disomogenea nei topi OI. La spettroscopia di Raman mostra un aumento del rapporto fosfato/collagene e una riduzione delle bande Amide I e III indicative di un minore contenuto di collagene e di alterazioni della struttura della tripla elica.
Nel complesso, il lavoro dimostra che la fragilità scheletrica nell’OI di tipo I non è spiegabile unicamente con la riduzione della massa ossea, ma è il risultato di una disorganizzazione gerarchica della struttura lamellare, di un deficit qualitativo del collagene, di una iper-mineralizzazione patologica e di un’eterogeneità meccanica su più scale. Paradossalmente, l’osso OI può risultare localmente più mineralizzato e rigido, ma meno capace di dissipare energia, più suscettibile alla propagazione delle microfratture e, nel complesso, meno resistente alla frattura.
In conclusione, lo studio dimostra come la suscettibilità alle fratture nell’OI sia una conseguenza diretta di alterazioni strutturali e composizionali multiscala piuttosto che della sola riduzione della massa ossea.
Referenze:
- Nijhuis WH, Eastwood DM, Allgrove J, Hvid I, Weinans HH, Bank RA, Sakkers RJ. Current concepts in osteogenesis imperfecta: bone structure, biomechanics and medical management. J Child Orthop. 2019 Feb 1;13(1):1-11. doi: 10.1302/1863-2548.13.180190. PMID: 30838070; PMCID: PMC6376438.
- Chretien A, Couchot M, Mabilleau G, Behets C. Biomechanical, Microstructural and Material Properties of Tendon and Bone in the Young Oim Mice Model of Osteogenesis Imperfecta. Int J Mol Sci. 2022 Sep 1;23(17):9928. doi: 10.3390/ijms23179928. PMID: 36077325; PMCID: PMC9456454.
- Treurniet S, Burger P, Ghyczy EAE, Verbraak FD, Curro-Tafili KR, Micha D, Bravenboer N, Ralston SH, de Vries R, Moll AC, Eekhoff EMW. Ocular characteristics and complications in patients with osteogenesis imperfecta: a systematic review. Acta Ophthalmol. 2022 Feb;100(1):e16-e28. doi: 10.1111/aos.14882. Epub 2021 May 19. PMID: 34009739; PMCID: PMC9290710.
- Ben Amor IM, Roughley P, Glorieux FH, Rauch F. Skeletal clinical characteristics of osteogenesis imperfecta caused by haploinsufficiency mutations in COL1A1. J Bone Miner Res. 2013 Sep;28(9):2001-7. doi: 10.1002/jbmr.1942. PMID: 23529829.