Bone homeostasis regulation by in vivo generation of osteoclast-derived apoptotic bodies using targeted self-assembly. Zhang P, Chen D, Fang Y, Li S, Zhou Z, Lu H, Cheng J, Wang H. Nat Commun. 2025 Dec 5;17(1):88. doi: 10.1038/s41467-025-66791-9. PMID: 41350258; PMCID: PMC12770474.
L’invecchiamento comporta sfide significative per la salute umana e l’osteoporosi rappresenta una delle condizioni più rilevanti, in particolare nelle donne in post-menopausa (1). Questa patologia è caratterizzata dal deterioramento della microarchitettura ossea e da una perdita accelerata di massa ossea (2). L’osteoporosi deriva da uno squilibrio tra riassorbimento e formazione ossea, attribuibile principalmente a un’eccessiva attività degli osteoclasti (OCs) (2). Tale alterazione dell’omeostasi scheletrica aumenta il rischio di fratture e contribuisce a un incremento della morbilità e della mortalità (3). Gli attuali trattamenti di prima linea, come i bifosfonati, agiscono inibendo indiscriminatamente gli OCs, inducendo apoptosi in tutte le cellule coinvolte nel riassorbimento osseo (4). Sebbene efficaci nel rallentare la progressione della malattia, queste terapie interferiscono anche con i processi mediati dai pre-osteoclasti (pre-OSc), compromettendo il fisiologico rimodellamento osseo e favorendo l’insorgenza di complicanze cliniche (5-6). Di conseguenza, emerge l’urgente necessità di sviluppare strategie terapeutiche mirate in grado di limitare selettivamente l’attività osteoclastica patologica, preservando al contempo la funzione dei pre-OCs e il rimodellamento osseo fisiologico.
In questo contesto si inserisce lo studio di Zhang et al., pubblicato nel 2025 sulla rivista Nature Communications, che propone una strategia innovativa volta a eliminare selettivamente gli OCs maturi patologici e a generare, in vivo, corpi apoptotici (apoptotic bodies, ABs) derivati dagli OCs, capaci di stimolare la formazione ossea e ristabilire l’omeostasi scheletrica senza compromettere i processi fisiologici di rimodellamento.
Gli autori descrivono lo sviluppo di OsteoSAVE, una nanoparticella peptidica “intelligente” caratterizzata da quattro elementi chiave:
- Targeting osseo, ottenuto mediante una sequenza di sei residui di acido aspartico che favorisce l’accumulo selettivo sulla superficie ossea;
- Selettività cellulare, conferita dalla carica negativa della nanoparticella, che promuove l’endocitosi da parte di cellule altamente fagocitiche come gli OCs maturi, ma non da parte di altre cellule del microambiente osseo;
- Attivazione enzimatica specifica, grazie alla presenza di un linker peptidico sensibile alla catepsina K (CTSK) un enzima fortemente espresso solo negli OCs maturi;
- Auto-assemblaggio supramolecolare.
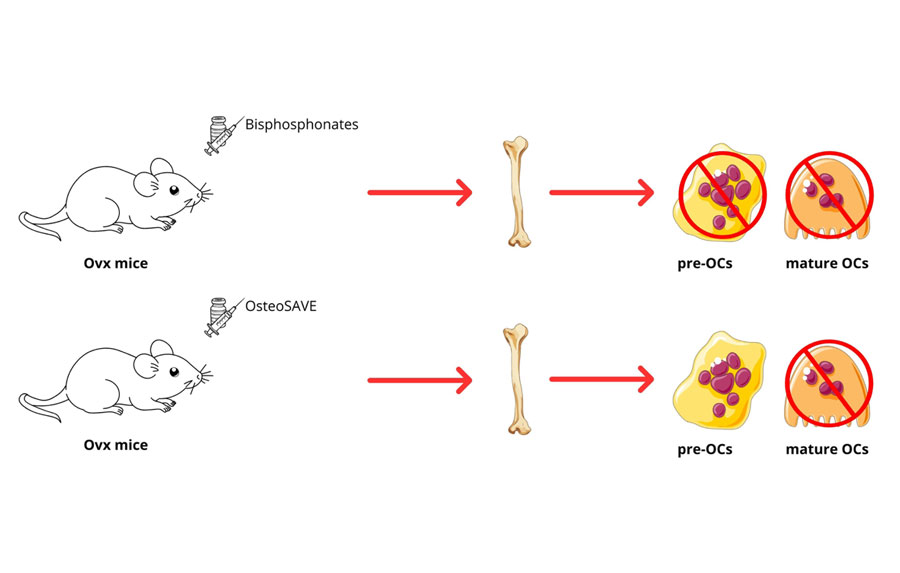
In particolare, dopo la scissione da parte della CTSK all’interno dei lisosomi, OsteoSAVE subisce una trasformazione strutturale e si auto-assembla in nanofibre in grado di danneggiare la membrana lisosomiale, inducendo apoptosi. Dopo l’accumulo a livello osseo, la nanoparticella viene internalizzata selettivamente dagli OCs maturi; la scissione del linker peptidico da parte della CTSK genera un frammento attivo che si organizza in nanofibre, determinando la rottura dei lisosomi, l’attivazione della cascata apoptotica e la morte selettiva degli OCs maturi. Durante questo processo apoptotico vengono rilasciati ABs arricchiti in PDGF-BB. Gli ABs vengono successivamente fagocitati dalle cellule staminali mesenchimali del midollo osseo (BMSCs), attivando la via di segnalazione PI3K/AKT e promuovendo il differenziamento osteogenico e la formazione di nuovo tessuto osseo. Gli studi in vitro dimostrano che OsteoSAVE non interferisce con il differenziamento dei pre-OCs, induce l’apoptosi selettiva degli OCs maturi e riduce in modo significativo il riassorbimento osseo. Inoltre, gli ABs generati mostrano una marcata capacità osteoinduttiva sulle BMSCs, risultando più efficaci rispetto a quelli indotti dall’alendronato, grazie ad un contenuto più elevato di PDGF-BB.
Gli studi in vivo, condotti su un modello murino ovariectomizzato (OVX) di osteoporosi post-menopausale, evidenziano che OsteoSAVE si accumula in modo selettivo nel tessuto osseo e migliora significativamente parametri quali la BMD, BV/TV e la Tb.Th. Inoltre, il trattamento riduce il numero e l’attività degli OCs e stimola la neoformazione ossea e l’angiogenesi. Nel complesso, i risultati dimostrano che OsteoSAVE esercita effetti terapeutici superiori rispetto all’alendronato, associati a un favorevole profilo di sicurezza, senza evidenza di infiammazione sistemica o tossicità.
Questo lavoro introduce un nuovo paradigma terapeutico per il trattamento dell’osteoporosi, basato non solo sull’inibizione del riassorbimento osseo, ma anche sull’accoppiamento funzionale tra eliminazione degli OCs patologici e rigenerazione ossea attiva. L’impiego di un sistema di auto-assemblaggio supramolecolare attivato da enzimi consente un’elevata precisione spaziale e cellulare, mentre la generazione in situ di ABs terapeutici supera i limiti associati alle strategie di somministrazione esogena.
In conclusione, OsteoSAVE rappresenta una piattaforma terapeutica altamente innovativa e potenzialmente traslabile, capace di ristabilire l’equilibrio del rimodellamento osseo in modo selettivo, efficace e sicuro. Questo studio apre nuove prospettive per lo sviluppo di terapie rigenerative mirate per l’osteoporosi e per altre patologie scheletriche associate all’invecchiamento.
Referenze:
- Reid IR. A broader strategy for osteoporosis interventions. Nat Rev Endocrinol. 2020 Jun;16(6):333-339. doi: 10.1038/s41574-020-0339-7. Epub 2020 Mar 17. PMID: 32203407.
- Walker MD, Shane E. Postmenopausal Osteoporosis. N Engl J Med. 2023 Nov 23;389(21):1979-1991. doi: 10.1056/NEJMcp2307353. PMID: 37991856.
- Dovjak P, Iglseder B, Rainer A, Dovjak G, Weber M, Pietschmann P. Prediction of Fragility Fractures and Mortality in a Cohort of Geriatric Patients. J Cachexia Sarcopenia Muscle. 2024 Dec;15(6):2803-2814. doi: 10.1002/jcsm.13631. Epub 2024 Nov 8. PMID: 39513358; PMCID: PMC11634494.
- Rogers MJ, Crockett JC, Coxon FP, Mönkkönen J. Biochemical and molecular mechanisms of action of bisphosphonates. Bone. 2011 Jul;49(1):34-41. doi: 10.1016/j.bone.2010.11.008. Epub 2010 Nov 26. PMID: 21111853.
- Xie H, Cui Z, Wang L, Xia Z, Hu Y, Xian L, Li C, Xie L, Crane J, Wan M, Zhen G, Bian Q, Yu B, Chang W, Qiu T, Pickarski M, Duong LT, Windle JJ, Luo X, Liao E, Cao X. PDGF-BB secreted by preosteoclasts induces angiogenesis during coupling with osteogenesis. Nat Med. 2014 Nov;20(11):1270-8. doi: 10.1038/nm.3668. Epub 2014 Oct 5. PMID: 25282358; PMCID: PMC4224644.
- Black DM, Geiger EJ, Eastell R, Vittinghoff E, Li BH, Ryan DS, Dell RM, Adams AL. Atypical Femur Fracture Risk versus Fragility Fracture Prevention with Bisphosphonates. N Engl J Med. 2020 Aug 20;383(8):743-753. doi: 10.1056/NEJMoa1916525. PMID: 32813950; PMCID: PMC9632334.