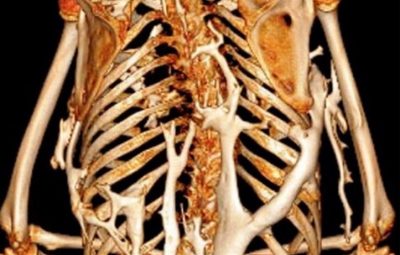
L’ossificazione eterotopica (HO) è una patologia caratterizzata da un’anormale mineralizzazione di tessuti connettivi, che può avere origine da fattori genetici o essere associata a trauma (1, 2). La forma più studiata di HO è la Fibrodisplasia Ossificante Progressiva (FOP) in cui sono state caratterizzate mutazioni gain-of-function dei geni ACVR1 (Activin Receptor Type 1) e BMPR1 (Bone Morphogenetic Protein Receptor 1) (3). Nella FOP, non è stata osservata una preponderanza etnica, razziale, geografica o di genere; l’aspettativa di vita è di circa 40 anni, con la morte che insorge per complicazioni dovute a insufficienza toracica (3).
Nel lavoro pubblicato su Nature Communications lo scorso Aprile, è stato riportato un caso raro di FOP caratterizzato da una rapida ossificazione dei tessuti connettivi, determinando la morte della paziente a solo 8 anni. Tale paziente ha manifestato i primi segni di ridotta mobilità a 5 mesi di età e la risonanza magnetica, effettuata a 8 mesi, ha mostrato una quasi completa ossificazione dei muscoli inter-costali. All’età di 5 anni, quasi tutti i muscoli scheletrici erano ormai sostituiti da tessuto calcificato determinando complicanze respiratorie che hanno causato la morte prematura della paziente. Nonostante la sintomatologia fosse riconducibile ad una FOP, la diagnosi è stata ritardata poiché l’analisi genetica di ACVR1 non ha evidenziato mutazioni in tale gene, suggerendo, pertanto, un meccanismo ancora sconosciuto alla base della patologia. Tecniche di array-CGH e FISH hanno permesso agli autori di identificare nelle cellule della paziente la presenza di una duplicazione inter-cromosomica: una porzione del cromosoma 2 è risultato inserito in uno dei due cromosomi X della bambina. Tale inserzione ha determinato l’interruzione di un dominio topologico (TAD) causando la forma ultra-rara di ossificazione eterotopica. In questo TAD sono contenuti due geni: ARHGAP36 (Rho GTPase Activating Protein 36) e IGSF1 (immunoglobulin superfamily member 1). Dall’analisi dei loro livelli di espressione nei fibroblasti della paziente è risultato un incremento di ARHGAP36, sia a livello trascrizionale che proteico; nessuna alterazione è stata riscontrata per IGSF1.
Per caratterizzare il ruolo di ARHGAP36 nella formazione ossea, sono stati studiati gli effetti della sua overespressione in cellule staminali mesenchimali isolate da donatori sani. L’analisi dei pattern di espressione ha identificato in tali cellule una modulazione di meccanismi coinvolti nella regolazione dell’osteogenesi attraverso le vie delle BMP e del TGFβ ed un incremento dei livelli trascrizionali di COL1A1, RUNX2 e COLX; tali dati sufferiscono che ARHGAP36 sia in grado di indurre un’ osteogenesi precoce.
Per confermare che ARHGAP36 fosse coinvolto anche nell’insorgenza del complesso quadro clinico della paziente, fibroblasti isolati dalla paziente e da donatori sani sono stati indotti a differenziare in osteoblasti per 5 settimane; i saggi in vitro hanno dimostrato una maggiore capacità delle cellule della paziente di formare matrice ossea.
Per la prima volta, in questo lavoro, il gene ARHGAP36 è stato associato alla FOP. Inoltre, dati preliminari ottenuti in vitro, suggeriscono come tale gene, identificato grazie ad una malattia rara, possa avere un ruolo chiave anche nell’attività fisiologica di formazione ossea. Ulteriori studi sono necessari per comprendere in modo più approfondito il meccanismo molecolare attraverso il quale ARHGAP36 sia coinvolto nella deposizione di matrice.
Commento a “Enhancer hijacking at the ARHGAP36 locus is associated with connective tissue to bone transformation” di Melo US, Jatzlau J, Prada-Medina CA, Flex E, Hartmann S, Ali S, Schöpflin R, Bernardini L, Ciolfi A, Moeinzadeh MH, Klever MK, Altay A, Vallecillo-García P, Carpentieri G, Delledonne M, Ort MJ, Schwestka M, Ferrero GB, Tartaglia M, Brusco A, Gossen M, Strunk D, Geißler S, Mundlos S, Stricker S, Knaus P, Giorgio E, Spielmann M. Nature Communications (2023) Apr 11;14(1):2034. doi: 10.1038/s41467-023-37585-8.
Referenze
1. Lawand J, Loeffelholz Z, Khurshid B, Barcak E. Heterotopic Ossification after Trauma. Orthop Clin North Am. 2023;54(1):37-46.
2. Cao G, Zhang S, Wang Y, Quan S, Yue C, Yao J, et al. Pathogenesis of acquired heterotopic ossification: Risk factors, cellular mechanisms, and therapeutic implications. Bone. 2023;168:116655.
3. Shaikh U, Khan A, Kumari P, Ishfaq A, Ekhator C, Yousuf P, et al. Novel Therapeutic Targets for Fibrodysplasia Ossificans Progressiva: Emerging Strategies and Future Directions. Cureus. 2023;15(7):e42614.